本试卷100分。考试时长90分钟。
可能用到的相对原子质量:H1 C 12 N 14 O 16 Na 23 S 32 Cl 35. 5
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1. 下列安全标识不适合在加油站张贴的是

2. 下列化学用语正确的是
A. 氨的电子式:
B. 中子数为20的Cl的核素:2017Cl
C. 甲烷的球棍模型:
D. 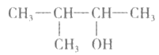 的系统命名:3-甲基-2-丁醇
的系统命名:3-甲基-2-丁醇
3. 下列说法不正确的是
A. 水泥、玻璃和陶瓷均属于无机非金属材料
B. 麦芽糖在酸或酶的催化下可水解为葡萄糖
C. 煤的干馏是实现煤综合利用的主要途径之一
D. 利用油脂在碱性条件下的水解反应可获得人造脂肪
4. 某品牌牙膏的成分含水、丙三醇、二氧化硅、苯甲酸钠、十二烷基硫酸钠和氟化钠等。已知:牙釉质中含有羟基磷酸钙[Ca5(PO4)3OH],是牙齿的保护层。在牙齿表面存在平衡:Ca5(PO4)3OH(s)
 5Ca2+(aq)+3PO43-(aq)+OH–(aq); Ksp[Ca5(PO4)3OH]>Ksp[Ca5(PO4)3F]。
5Ca2+(aq)+3PO43-(aq)+OH–(aq); Ksp[Ca5(PO4)3OH]>Ksp[Ca5(PO4)3F]。
下列说法不正确的是
A. 若使牙膏呈弱酸性,更有利于保护牙釉质
B. 丙三醇的俗称是甘油
C. SiO2是摩擦剂,有助于去除牙齿表面的污垢
D. NaF能将Ca5(PO4)3OH转化为更难溶的Ca5(PO4)3F,减少龋齿的发生
5. 用下列仪器或装置进行相应实验,能达到实验目的的是
|
|
|
|
A. 蒸发结晶制备 NaHCO3晶体 | B. 分离苯和溴苯 | C. 实验室制取蒸馏水 | D. 配制100 mL 0.100mol/LNaCl溶液 |
6. 下列方程式与所给事实不相符的是
A. 向KMnO4酸性溶液中滴加H2C2O4溶液,溶液褪色:
2MnO4–+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
B. 向沸水中滴加饱和FeCl3溶液,制Fe(OH)3胶体:Fe3++3H2O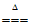 Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
C. 向银氨溶液中滴加乙醛,水浴加热,析出光亮银镜:
CH3CHO+2Ag(NH3)2OH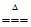 CH3COONH4+2Ag↓+3NH3+H2O
CH3COONH4+2Ag↓+3NH3+H2O
D. Na2O2用作潜水艇供氧剂:2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2
7. 下表是周期表中5种元素的相关信息,其中Q、W、X位于同一周期。
元素 | 信息 | 元素 | 信息 |
Q | 位于周期表的第3周期第ⅢA族 | Y | 焰色反应为紫色 |
W | 最高正化合价为+7价 | Z | 原子结构示意图为 |
X | 本周期中原子半径最大 |
|
下列说法正确的是
A. Q在地壳中含量最高
B. 元素的金属性:X>Y
C. 气态氢化物的稳定性:Z>W
D. Q的最高价氧化物对应的水化物既能与NaOH反应,又能与HCl反应
8. 糠醛(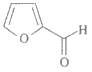 )与苯酚可以发生聚合反应,得到糠醛树脂,其结构类似于酚醛树脂,糠醛树脂可用作砂轮、砂纸、砂布的黏合剂。下列说法不正确的是
)与苯酚可以发生聚合反应,得到糠醛树脂,其结构类似于酚醛树脂,糠醛树脂可用作砂轮、砂纸、砂布的黏合剂。下列说法不正确的是
A. 糠醛的分子式为C5H4O2
B. 糠醛的同分异构体可能含羧基
C. 合成糠醛树脂的反应属于缩聚反应
D. 线型糠醛树脂的结构简式为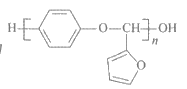
9. CO2催化加氢制备CH3OH是CO2资源化利用的重要途径。已知下图所示的反应的能量变化。
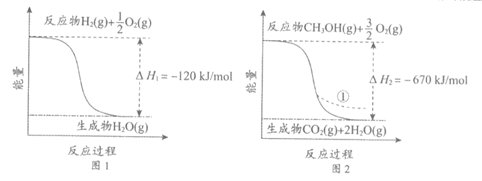
下列说法不正确的是
A. 由图1推知反应物断键吸收的能量小于生成物成键释放的能量
B. 图2中,若生成的H2O为液态,则能量变化曲线为①
C. CO2
(g)+3H2
(g)
===CH3OH (g)+ H2O (g)
△H=+310kJ/mol
D. 制备CH3OH的反应使用催化剂时,其△H不变
10. 工业上用氨水作为沉淀剂去除酸性废水中的铅元素。除铅时,体系中含铅微粒的物质的量分数(d)与溶液pH的关系如图。[已知:Pb(OH)2难溶于水]
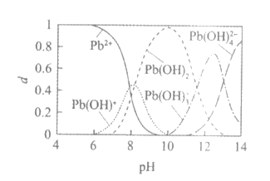
下列说法不正确的是
A. 氨水中:c (NH4+)+c(H+)=c(OH–)
B. 酸性废水中的含铅微粒有Pb2+、Pb (OH)+
C. pH=12时,溶液中的离子有且仅有Pb (OH)3–、Pb (OH)42-、OH–和H+
D. pH=10时,除铅效果最好
11. 在体积恒为1L的密闭容器中发生反应:A(g)+ B(g)
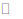 C(g)+ D(g)
C(g)+ D(g)
△H<0。测得不同条件下A的平衡转化率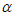 (A)如下表。
(A)如下表。
实验序号 | 实验温度 | 初始投料量 | α(A)/% | |
n0 (A) /mol | n0(B)/mol | |||
1 | T1 | 10 | 10 | 50 |
2 | T2 | 10 | 10 | a |
3 | T3 | 15 | 10 | 40 |
下列说法正确的是
A. 当容器内压强不变时,反应达到化学平衡状态
B. T1时,反应的化学平衡常数值为2
C. 若T2<T1,则a<50
D. T1=T3
12. 化学家利用“自然化学连接法“提高蛋白质合成的效率,反应机理如图(其中 和
和 各表示一种多肽片段)。
各表示一种多肽片段)。
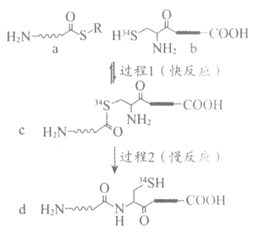
下列说法不正确的是
A. 过程1中有C-S键和34S-H键的断裂
B. a、b生成c的同时还生成RH
C. c和d互为同分异构体
D. 总反应的化学反应速率主要取决于过程2
13. 下图是“海水—河水“浓差电池装置示意图(不考虑溶解氧的影响),其中a、b均为Ag/AgCl复合电极,b的电极反应式为AgCl+e–==Ag+Cl–。下列说法正确的是
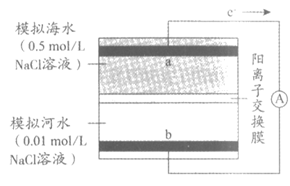
A. a的电极反应式为Ag-e–=Ag+
B. 内电路中,Na+由b极区向a极区迁移
C. 工作一段时间后,两极NaCl溶液的浓度差减小
D. 电路中转移1mole–时,理论上a极区模拟海水的质量减少23 g
14. 同学们探究不同金属和浓硫酸的反应。向三等份浓硫酸中分别加入大小相同的不同金属片,加热,用生成气体进行下表实验操作并记录实验现象。
实验操作 | 实验现象 | ||
金属为铜 | 金属为锌 | 金属为铝 | |
点燃 | 不燃烧 | 燃烧 | 燃烧 |
通入KMnO4酸性溶液 | 褪色 | 褪色 | 褪色 |
通入CuSO4溶液 | 无明显变化 | 无明显变化 | 出现黑色沉淀 |
通入品红溶液 | 褪色 | 褪色 | 不褪色 |
已知:H2S+CuSO4=CuS↓+H2SO4(CuS为黑色固体);H2S可燃。
下列说法不正确的是
A. 加入铜片的实验中,使KMnO4酸性溶液褪色的气体是SO2
B. 加入铝片的实验中,燃烧现象能证明生成气体中一定含H2S
C. 加入锌片的实验中,生成的气体一定是混合气体
D. 金属与浓硫酸反应的还原产物与金属活动性强弱有关
第二部分
本部分共5题,共58分。
15. (11分)氧族元素(O、S、Se等)及其化合物在生产生活中发挥着巨大作用。
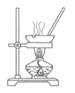
(1)实验室用70%H2SO4溶液和Na2SO3粉末在常温下反应制备SO2,装置如右图。
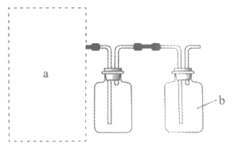
①将虚线框a内的仪器补充完整(夹持装置可省略)。
②b为尾气吸收装置,其中的试剂为_______________。
(2)生物浸出法可有效回收含硫矿石中的有色金属,某种生物浸出法中主要物质的转化路径如图。
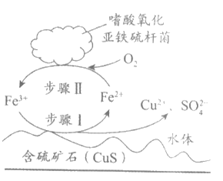
①步骤I反应的离子方程式为_______________。
②生物浸出法的总反应的氧化剂是___________。
(3)以工业硒为原料制备高纯硒的流程如下图。
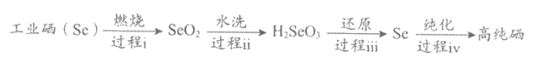
①下列说法正确的是___________(填字母序号)。
a. 过程i到过程iii均为氧化还原反应
b. H2SeO3既有氧化性,又有还原性
c. SeO2能与NaOH反应生成Na2SeO3和H2O
d. Se与H2化合比S与H2化合容易
②过程iii中使用的还原剂为N2H4·nH2O,对应产物是N2。理论上,过程i消耗的O2与过程iii消耗的N2H4·nH2O的物质的量之比为___________(工业硒中杂质与O2的反应可忽略)。
16. (9分)合理利用废旧铅蓄电池可缓解铅资源短缺,同时减少污染。
I. 一种从废旧铅蓄电池的铅膏中回收铅的生产流程如下图(部分产物已略去)
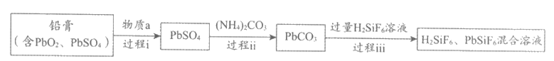
已知:
①不同铅化合物的溶度积(25℃):Ksp(PbSO4)= 2.5×10-8,Ksp(PbCO3)=7.2×10-14;
②PbSiF6和H2SiF6均为能溶于水的强电解质。
(1)过程i中,物质a表现___________(填“氧化“或“还原“)性。
(2)过程ii需要加入(NH4)2CO3溶液,从化学平衡的角度解释其作用原理:___________。
(3)过程iii发生反应的离子方程式为___________。
II. 工业上用PbSiF6、H2SiF6混合溶液作电解液,用电解法实现粗铅(主要杂质为(Cu、Ag、Fe、Zn,杂质总质量分数约为4%)提纯,装置示意图如下。
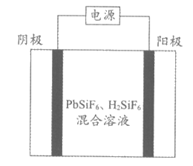
(4)下列说法正确的是___________(填字母序号)。
a. 阴极为粗铅,纯铅在阳极析出
b. 电解产生的阳极泥的主要成分为Cu和Ag
c. 工作一段时间后,需要补充Pb2+以保持溶液中c(Pb2+)的稳定
(5)铅的电解精炼需要调控好电解液中的c(H2SiF6)。其他条件相同时,测得槽电压(槽电压越小,对应铅产率越高)随起始时溶液中c (H2SiF6)的变化趋势如图。
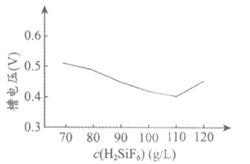
由图可推知,随c(H2SiF6)增大,铅产率先增大后减小,减小的原因可能是__________________________。
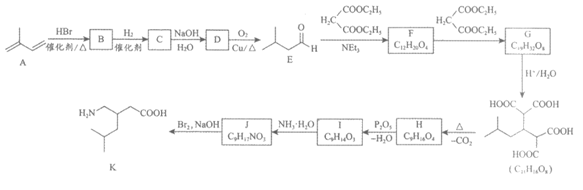
17. (13分)普瑞巴林(K)是一种抗癫痫药物,可用异戊二烯(A)为原料来合成,路线如下图。
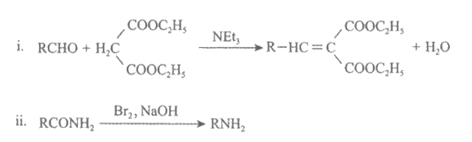
已知:
(1)A的官能团是___________(写中文名称)。
(2)C的结构简式为___________。
(3) D→E的化学方程式是___________。
(4) F→G的反应类型为_______________。
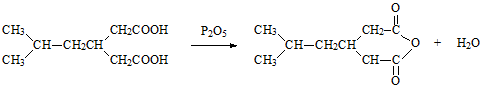
(5)I中含有一个六元环,H生成I的化学方程式是___________。
(6)若H未发生脱水缩合生成I,根据H的酸性推断其直接与过量NH3·H2O反应的产物是___________。
(7)将K中的碳原子编号标记为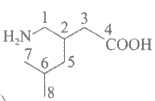 ,其中由CH2(COOC2H5)2提供的碳原子的编号为___________(填字母序号)。
,其中由CH2(COOC2H5)2提供的碳原子的编号为___________(填字母序号)。
a. 1, 2, 3, 4 b. 1, 3, 4 c. 2, 3, 4 d. 1, 2, 3
18. (12分)具有十八面体结构的Ag3PO4晶体是一种高效光催化剂,可用于实现“碳中和“,也可用于降解有机污染物。
I. 配位–沉淀法制备Ag3PO4高效光催化剂
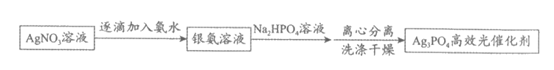
已知:i. Ag3PO4难溶于水,可溶于硝酸;
ii. Ag3PO4沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能;
iii. 银氨溶液中存在:Ag(NH3)+2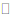 Ag++2NH3。
Ag++2NH3。
(1)配制银氨溶液时的反应现象是___________。
(2)加入Na2HPO4溶液时,发生以下反应,请将离子方程式补充完整:
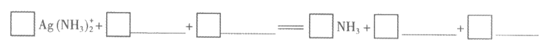
(3)AgNO3和Na3PO4在溶液中反应也可制得Ag2PO4固体,但制得的Ag3PO4固体光催化性能极差。从速率角度解释其原因:______________________。
Ⅱ. Ag3PO4光催化剂的使用和再生
已知:Ag3PO4晶体在光照条件下发挥催化作用时,首先引发以下反应。
a. Ag3PO4 [Ag3PO4 ]
[Ag3PO4 ]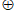 + e–
+ e–
(4) Ag3PO4光催化CO2制备甲醇可实现“碳中和“,a的后续反应如下。
2H2O+4[Ag3PO4]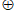
 O2+4H++4 Ag3PO4,CO2+6e–+6H+= CH3OH+H2O
O2+4H++4 Ag3PO4,CO2+6e–+6H+= CH3OH+H2O
则由CO2制备甲醇的总反应的化学方程式为______________________。
(5)Ag3PO4光催化降解RhB(代表有机污染物),RhB被氧化成CO2和H2O。a的后续反应如下。
O2+e–=O–2,H2O+[Ag3PO4] =H++·OH+Ag3PO4,……
=H++·OH+Ag3PO4,……
注:Ag3PO4在该催化过程中可能发生光腐蚀,生成单质银,影响其光催化性能。
用Ag3PO4依次降解三份相同的废水,测得3次降解过程中RhB的残留率(c/c0,即时浓度与起始浓度之比)随时间变化的曲线如图。
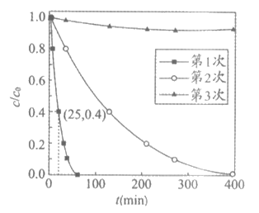
①下列说法正确的是___________(填字母序号)。
a. ·OH和O2–是降解RhB的重要氧化剂
b. 第1次使用后Ag3PO4的光催化性能降低
c. 该实验条件下,Ag3PO4使用两次即基本失效
②第1次光降解时,0~25 min内的反应速率为___________mol/(L·min)。(废水中RhB初始浓度c0为100 mg/L,RhB的摩尔质量为Mg/mol)
19. (13分)实验小组探究不同浓度CuCl2溶液的电解反应。分别用石墨电极电解0.1 mol/L CuCl2溶液和5 mol/L CuCl2溶液,记录实验现象如下表。
实验装置 | 实验编号及试剂 | 实验现象 |
| ①0.1 mol/L CuCl2溶液(蓝色) | 阳极:产生有刺激性气味的气体 阴极:电极上有红色固体析出 |
②5 mol/L CuCl2溶液(绿色) | 阳极:产生有刺激性气味的气体 阴极:电极上有少量红色固体和白色固体析出,同时电极附近液体变为黑色 |
(1)经检验,阳极产生的气体能使湿润的淀粉KI试纸变蓝。①中电解反应的化学方程式为__________________________。
I. 探究②中产生白色固体的原因。
查阅资料:
i. 阴极附近的白色固体为CuCl,Ksp(CuCl)=1.2×10-6;
ii. Cu+在水溶液中单独存在时不稳定,容易发生反应:2Cu+
(aq)
 Cu(s)+ Cu2++(aq)。
Cu(s)+ Cu2++(aq)。
结合资料分析CuCl产生的路径有如下两种可能:
(2)路径1:阴极发生电极反应分两步,i. _______________,ii. Cu+e–=Cu,同时伴随反应Cu++Cl–= CuCl↓,生成白色沉淀。
(3)路径2:阴极发生电极反应Cu2++2e–=Cu,而后发生反应a:___________(写出离子方程式),生成白色沉淀。同学们通过实验证明反应a可以发生,其实验操作和现象是___________。
Ⅱ. 探究②中阴极区液体中黑色物质的成分。
进一步查阅资料,提出以下猜想。
猜想1,生成氯氧化铜,进而转化为极细小的氧化铜;
猜想2. 生成铜的速率快,形成黑色纳米铜;
猜想3. 发生反应Cu2++ Cu++ 4Cl–+H2O  [Cu(II) Cu(I)Cl4(H2O)] –(棕黑色)。
[Cu(II) Cu(I)Cl4(H2O)] –(棕黑色)。
(4)若猜想1成立,则阴极一定还存在的电极反应是______________________。
取2 mL黑色液体于试管中,分别加入不同试剂,记录实验现象如下表。
实验编号 | ③ | ④ | ⑤ |
加入试剂 | 4 mL浓HNO3 | 4 mL 浓HCl | 4 mL H2O |
实验现象 | 溶液变澄清,呈绿色,试管 口有浅红棕色气体生成 | 黑色液体颜色变深 | 溶液变澄清,呈绿色,同时 出现少量白色沉淀 |
(5)甲同学根据实验③产生的现象得出结论:黑色液体中一定有纳米铜。乙同学认为甲同学的结论不合理,他做出判断的依据是___________。
(6)由上述实验可得到的关于黑色物质成分的结论是______________。
参考答案
第一部分
选择题
(每小题只有1个选项符合题意,共14个小题,每小题3分,共42分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
答案 | C | D | D | A | C | B | D |
题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
答案 | D | B | C | D | B | C | B |
第二部分
非选择题(共58分)
评阅非选择题时请注意:
若无特别说明,每空2分。
文字表述题中其他答案合理也给分。
方程式中的产物漏写“↑”或“↓”不扣分;化学专用词汇若出现错别字为0分。
15.(11分)
(1)①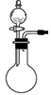
② NaOH溶液(1分)
(2)① 8Fe3+ + CuS +4H2O == Cu2++8Fe2++SO2- 4+8H+
② O2
(3)① bc ② 1∶1
16.(9分)
(1)还原(1分)
(2)PbSO4在溶液中存在PbSO4(s) Pb2+(aq) + SO2- 4(aq),加入(NH4)2CO3溶液,由于Ksp(PbCO3)<Ksp(PbSO4), CO2- 3+Pb2+
Pb2+(aq) + SO2- 4(aq),加入(NH4)2CO3溶液,由于Ksp(PbCO3)<Ksp(PbSO4), CO2- 3+Pb2+
== PbCO3↓,使c(Pb2+)减小,上述PbSO4的溶解平衡正向移动,PbSO4转化为PbCO3
(3)PbCO3+ 2H+
== Pb2+ + H2O +
CO2↑
(4)bc
(5)c(H2SiF6)增大,电解液中c(H+)增大,阴极发生副反应2H++ 2e− == H2↑,影响Pb2+放电,使铅产率减小,槽电压增大
17. (13分)
(1)碳碳双键(1分)
(2)(CH3)2CHCH2CH2Br
(3)
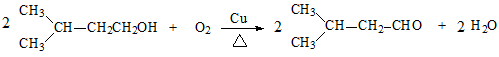
或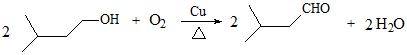
(4)加成反应
(5)
或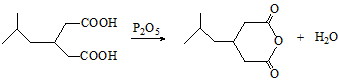
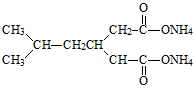
(6)
或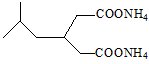
(7)B
18. (12分)
(1)先产生沉淀,继续滴加氨水,溶液变澄清
(2)3Ag(NH3)+ 2 + HPO2- 4 + OH-== 6NH3+Ag3PO4↓+ H2O
(3)AgNO3和Na3PO4溶液中c(Ag+)和c(PO43-)较大,沉淀反应速率快,不利于生成具有十八面体结构的Ag3PO4晶体
(4)2 CO2 + 4H2O 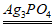 2CH3OH + 3O2
2CH3OH + 3O2
(5)① abc ②
 19.(13分)
19.(13分)
(1)CuCl2
== Cu + Cl2↑
(2) Cu2+ + e-== Cu+(1分)
(3)Cu + Cu2+ + 2Cl-== 2CuCl↓
在5 mol/L CuCl2溶液中加入少量铜粉(或打磨过的铜片),观察到有白色固体生成
(4)2H2O + 2e-== H2↑+ 2OH-
(5)若猜想3成立,其中+1价铜具有还原性,也可与硝酸反应产生类似的现象
(6)黑色物质中一定含[Cu(II)Cu(I) Cl4(H2O)]-,可能含纳米铜粉