北京101中学2020-2021学年下学期高一年级期末考试化学试卷
本试卷分为Ⅰ卷、Ⅱ卷,共26个小题,满分100分;答题时间为90分钟;
可能用到的相对原子质量:
H1 C12 O16
Ⅰ卷
选择题(共42分)
(共21道小题,每小题只有一个选项符合题意,每小题2分。)
1.下列发电厂(站)的电能由化学能直接转化而成的是
A | B | C | D |
|
|
|
|
燃料电池发电站 | 地热发电厂 | 风力发电厂 | 水力发电站 |
2.化学与生活密切相关。下列说法不正确的是
A.高温可杀灭细菌,是由于高温可使蛋白质变性
B.淀粉水解的最终产物是葡萄糖
C.油脂、蛋白质、糖类属于高分子化合物
D.维生素C常与补铁剂(有效成分中铁元素为+2价)同服,是由于它具有还原性
3.NA代表阿伏加德罗常数的数值。下列说法正确的是
A.标准状况下2.24L氯气与水充分反应转移电子数为0.1NA
B.1mol-OH和1molOH–含有的电子数均为10NA
C.标准状况下2.24L的CCl4中含有的C—Cl键数为0.4NA
D.2.8gC2H4中含有0.4NA个极性键
4.下列化学用语表示正确的是
A.Ca2+的结构示意图:
B.基态碳原子的轨道表示式:
C.甲烷的球棍模型:
D.基态铜原子(29Cu)的价层电子排布式:3d104s1
5.X、Y、Z三种元素的原子,其价电子排布式分别为ns1、3s23p2和2s22p4,由这三种元素组成的化合物的化学式可能是
A.XYZ2 B.X2YZ3 C.X2YZ2 D.XYZ3
6.根据下表中烃的分子式排列规律,判断空格中烃的同分异构体数目是
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
A.3 B.4 C.5 D.6
7.下列与原子核外电子排布规律相关的叙述中(n为电子层数),不正确的是
A.第三周期元素的基态原子中,未成对电子数最多的是磷
B.电子填入能级的顺序是np→(n+1)s,因此原子核外最外层电子数一般不超过8
C.由3d能级有5个轨道可知,元素周期表中第四周期元素比第三周期元素多10种
D.基态原子的最外层电子排布为ns2的元素,在元素周期表中均位于第ⅡA族
8.元素周期律的发现是近代化学史上的一座里程碑。下列事实不能用元素周期律解释的是
A.Na2CO3溶液中加盐酸,产生气泡
B.常温下,形状和大小相同的Mg、Al与同浓度盐酸反应,Mg条更剧烈
C.气态氢化物的稳定性:H2O>H2S
D.Br2从NaI溶液中置换出I2
9.关于如图所示的原电池,下列说法不正确的是
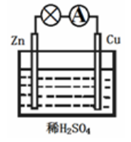
A.该装置能将化学能转化为电能
B.Zn为负极,发生氧化反应
C.正极的反应为2H++2e–=H2↑
D.电子由铜片通过导线流向锌片
10.如图所示为某基元反应过程的能量变化(E1、E2、E3均大于0)。下列说法正确的是
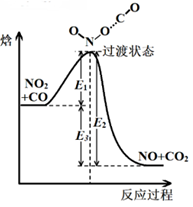
A.该反应为吸热反应
B.E1+E3为该反应的活化能
C.图中对应的该反应的焓变DH=-E2
D.NO2和CO分子发生有效碰撞才能形成过渡状态分子
11.实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
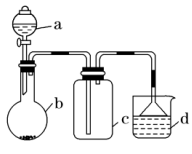
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | 饱和NaCl溶液 |
12.空气吹出法是工业规模海水提溴的常用方法,流程如下:
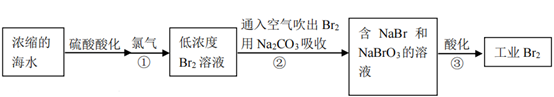
下列说法不正确的是
A.步骤①发生的主要反应为:Cl2+2Br−=Br2+2Cl−
B.步骤②③的目的是富集溴元素
C.获得工业Br2的方法是过滤
D.步骤②发生的主要反应为:3Br2+3Na2CO3=5NaBr+3CO2+NaBrO3
13.火法炼铜的原理:Cu2S+O2
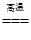 2Cu+SO2。下列说法不正确的是
2Cu+SO2。下列说法不正确的是
A.O2在该反应中作氧化剂
B.所得气体通入品红溶液,溶液褪色
C.3.2gO2参与反应时,该反应中电子转移的总数约为4×6.02×1022
D.所得气体经处理可作工业制硫酸的原料
14.把镁条投入到盛有盐酸的敞口容器里,产生H2的速率如图所示。在下列因素中,能影响此反应速率的因素是
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl−的浓度
A.①④ B.②③ C.①②③ D.③④
15.下列离子方程式书写正确的是
A.氨水与稀盐酸反应:OH−+H+==H2O
B.CuO与稀硝酸反应:CuO+2H+==Cu2++H2O
C.Ba(OH)2溶液与稀硫酸反应:Ba2++SO42−==BaSO4↓
D.大理石与稀盐酸反应:CO32−+2H+==CO2↑+H2O
16.已知:2H2(g)+O2(g)===2H2O(g) ΔH=-483.6kJ/mol
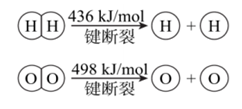
下列说法不正确的是
A.利用该反应原理可设计氢氧燃料电池
B.可推算H—O键的键能为926.8kJ/mol
C.H2O(g)===H2(g)+1/2O2(g) ΔH=+241.8kJ/mol
D.H2分子和H2O分子中都只含共价键
17.CO2催化加氢制备CH3OH是CO2资源化利用的重要途径。已知下图所示的反应的能量变化。
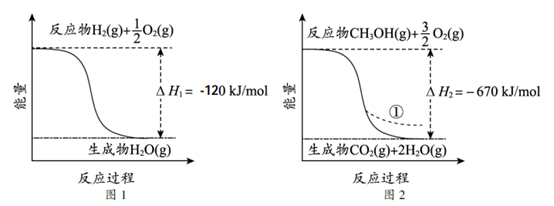
下列说法不正确的是
A.由图1推知反应物断键吸收的能量小于生成物成键释放的能量
B.图2中,若生成的H2O为液态,则能量变化曲线为①
C.CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=+310kJ/mol
D.制备CH3OH的反应使用催化剂时,其ΔH不变
18.下列说法正确的是
①可用酸性高锰酸钾溶液鉴别甲烷和乙烯
②乙醇可与钠反应,因为分子中含有羟基
③可用分液的方法分离酒精和水
④苯不能使酸性高锰酸钾溶液褪色,能证明苯分子中的碳碳键不是单、双键交替排列
⑤CH3COOH可与小苏打溶液反应,生成气泡
⑥正丁烷和异丁烷互为同系物
A.①②③⑤ B.②③④⑤ C.②④⑤⑥ D.①②④⑤
19.乙酸分子的结构式为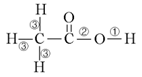 ,下列反应及断键部位正确的是
,下列反应及断键部位正确的是
①乙酸的电离,是①键断裂
②乙酸与乙醇发生酯化反应,是②键断裂
③在红磷存在时,Br2与CH3COOH的反应:
CH3COOH+Br2 CH2Br-COOH+HBr,是③键断裂
CH2Br-COOH+HBr,是③键断裂
④乙酸变成乙酸酐的反应:2CH3COOH
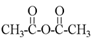 +H2O,是①②键断裂
+H2O,是①②键断裂
A.①②③ B.①②③④ C.②③④ D.①③④
20.一定温度下,把2.5molA和2.5molB混合盛入容积为2L的密闭容器里,发生如下反应:3A(g)+B(s)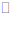 xC(g)+2D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.2mol·L-1·s-1,同时生成1molD,下列叙述中不正确的是
xC(g)+2D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.2mol·L-1·s-1,同时生成1molD,下列叙述中不正确的是
A.反应达到平衡状态时A的转化率为60%
B.x=4
C.若D的浓度不再变化,则该可逆反应达到化学平衡状态
D.反应达到平衡状态时,相同条件下容器内气体的压强与起始时压强比为6:5
21.用下图装置探究原电池中的能量转化。图中注射器用来收集气体并读取气体体积,记录实验数据如下表:
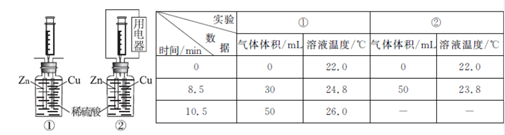
下列说法不正确的是
A.两个装置中反应均为Zn+H2SO4=ZnSO4+H2↑
B.0~8.5min内,生成气体的平均速率①<②
C.时间相同时,对比两装置的溶液温度,说明反应释放的总能量①>②
D.生成气体体积相同时,对比两装置的溶液温度,说明②中反应的化学能部分转化为电能
II卷
非选择题(共58分)
22.(10分)已知乙烯能发生以下转化:
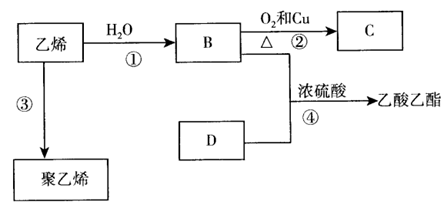
(1)写出官能团的名称或结构简式:
B中含官能团的名称___________;D中含官能团的结构简式___________。
(2)写出反应的化学方程式:
①____________________________________;反应类型:____________。
②____________________________________;反应类型:____________。
③____________________________________;反应类型:____________。
④____________________________________;反应类型:____________。
23.(12分)化学反应是有历程的。研究反应机理对于认识反应和调控反应意义重大。
I:NO和H2可以反应生成N2和水蒸气,其中每生成7gN2,放出166kJ的热量。该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n待测),其反应历程包含下列两步:
①2NO+H2===N2+H2O2(慢) Ea1
②H2O2+H2===2H2O(快) Ea2
T℃时测得有关实验数据如下:
序号 | c(NO)/(mol·L-1) | c(H2)/(mol·L-1) | 速率/(mol·L-1·min-1) |
Ⅰ | 0.0060 | 0.0010 | 1.8×10-4 |
Ⅱ | 0.0060 | 0.0020 | 3.6×10-4 |
Ⅲ | 0.0010 | 0.0060 | 3.0×10-5 |
Ⅳ | 0.0020 | 0.0060 | 1.2×10-4 |
(1)该反应的热化学方程式为__________________________________________。
(2)活化能Ea1_________Ea2(填“>或<或=“)。
(3)m=_________,n=_________。
II:催化剂参与反应过程,能加快反应速率。
(4)2SO2+O2=2SO3的速率很慢,NO和NO2都可以作为该反应的催化剂,发生两步基元反应,快速生成SO3。请结合催化剂的特点,写出NO做催化剂时,这两步基元反应的方程式__________________。
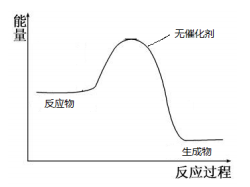
(5)请在如图中画出加入催化剂时的能量变化过程
(已知该两步反应均为放热反应)。
24.(10分)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 0.04mol/LKMnO4溶液 | 3mol/L稀硫酸 | ||
1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
2 | 2.0 | 3.0 | 3.0 | 2.0 | 5.2 |
3 | 1.0 | 4.0 | 3.0 | 2.0 | 6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是_______________________________
________________________________________________________________________。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:
υ(KMnO4)= ____________。
(3)实验中加入H2O的目的是____________________________________。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。

(5)该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设:生成的Mn2+对该反应有催化作用。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 0.04mol/L KMnO4溶液 | 3mol/L稀硫酸 | |||
4 | 3.0 | 2.0 | 3.0 | 2.0 | ________ | t |
③现象及结论:依据现象____________,得出该小组同学提出的假设成立。
25.(14分)以锌锰废电池中的碳包(含碳粉、Fe、Cu、Ag和MnO2等物质)为原料回收MnO2的工艺流程如下:
I.将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
II.将滤渣a在空气中灼烧除去碳粉,得到粗MnO2;
III.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
IV.向III所得溶液(pH约为6)中缓慢滴加0.50mol•L-1Na2CO3溶液(pH约为12),过滤,得滤渣b,其主要成分为MnCO3;
V.滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2。
(1)Ι中Ag与足量稀HNO3反应生成NO的化学方程式为_____________________。
(2)已知II的灼烧过程中同时发生反应:
MnO2(s)+C(s)===MnO(s)+CO(g) △H=+24.4kJ•mol-1
MnO2(s)+CO(g)===MnO(s)+CO2(g) △H=-148.1kJ•mol-1
写出MnO2和C反应生成MnO和CO2的热化学方程式:
________________________________________________________________________。
(3)H2O2的电子式为____________,分子中含有的化学键类型为____________、____________。
(4)III中MnO2溶解的离子方程式为________________________,溶解一定量的MnO2,H2O2的实际消耗量比理论值高,用化学方程式解释原因:________________________。
(5)IV中,若改为“向0.50mol•L-1Na2CO3溶液中缓慢滴加III所得溶液“,滤渣b中会混有较多________________________杂质。
(6)V中MnCO3在空气中灼烧的化学方程式为_____________________________。
26.(12分)某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。
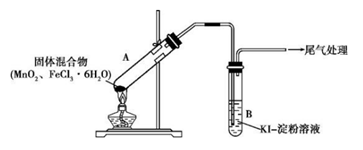
实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | ⅰ. A中部分固体溶解,上方出现白雾 ⅱ. 稍后,产生黄色气体,管壁附着黄色液滴 ⅲ. B中溶液变蓝 |
(1)推测现象ⅰ中的白雾中含有的物质是______________________________。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。通过该实验说明现象ⅱ中黄色气体含有_____________________________________________。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
①实验b检出的气体使之变蓝,反应的离子方程式是__________________________。实验证实推测成立。
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是__________________________________________。
(4)为进一步确认黄色气体中是否含有Cl2。
查阅资料:酸性条件下,O2不能氧化Br−。小组同学提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI–淀粉溶液替换为NaBr溶液;检验Fe2+。
现象如下:
方案1 | B中溶液变为蓝色 |
方案2 | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试剂是_______________,其作用是_____________________。
②方案2中检验Fe2+的原因是_____________________________________________。
③综合方案1、2的现象,说明选择NaBr溶液的依据是_______________。
参考答案
Ⅰ卷
选择题(共42分)
1-5.ACDDB 6-10.ADADD
11-15.BCCCB 16-20.BBDBD 21.C
II卷
非选择题(共58分)
22.(10分)
(1)羟基 —COOH
(2)①CH2=CH2+H2O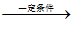 CH3CH2OH 加成反应
CH3CH2OH 加成反应
②2CH3CH2OH+O2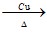 2CH3CHO+2H2O 氧化反应
2CH3CHO+2H2O 氧化反应
③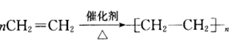 加聚反应
加聚反应
④CH3COOH+C2H5OH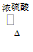 CH3COOC2H5+H2O 酯化反应或取代反应
CH3COOC2H5+H2O 酯化反应或取代反应
23.(12分)
I:(1)2NO(g)+2H2(g)===N2(g)+2H2O(g) ΔH=-664kJ·mol-1
(2)>
(3)2 1
II:(4)2NO+O2=2NO2,NO2+SO2=SO3+NO
(5)略
24.(10分)
(1)其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大
(2)3×10-3mol/(L·min)
(3)保证只有H2C2O4浓度不同,H2SO4和KMnO4的浓度均相同。
(5)②MnSO4
③与实验1比较,溶液褪色所需时间短(不写“与实验1比较“扣1分);
或:所用时间(t)小于4.0min(或其他合理答案)
25.(14分)
(1)3Ag+4HNO3===3AgNO3+NO+2H2O
(2)2MnO2(s)+C(s)===2MnO(s)+CO2(g) △H=-123.7kJ•mol-1
(3)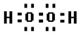 (1分)极性键、非极性键
(1分)极性键、非极性键
(4)MnO2+H2O2+2H+===Mn2++O2+2H2O;2H2O2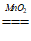 O2+2H2O
O2+2H2O
(5)Mn(OH)2或Mn2(OH)2CO3等。(1分)
(6)2MnCO3+O2===2MnO2+2CO2 条件:灼烧。注:写“加热“、“高温“不扣分。
26.(12分)
(1)HCl,H2O(1分)
(2)FeCl3(1分)
(3)①2Fe3++2I–===I2+2Fe2+
②在KI–淀粉溶液中滴加少量盐酸,放置在空气中,观察溶液变蓝。
(4)①饱和食盐水(1分);
除去Cl2中含有的FeCl3和HCl(1分)。
②通过未检出Fe2+,说明是Cl2氧化Br–而不是Fe3+氧化的,证明了黄色气体中一定有Cl2
③氧化性强弱顺序:Cl2>Br2>Fe3+




