北京101中学2023届上学期高三年级9月月考化学试卷
本试卷分为I卷、Ⅱ卷两部分,共19个小题,满分100分;答题时间为90分钟。
相对原子质量:S 32 Cl 35.5
I卷:选择题(共42分)
每小题只有一个选项符合题意。每小题3分,共42分。
1. 2019年,我国青年化学家雷晓光被遴选为“青年化学家元素周期表“氮元素的代言人。下列与氮元素有关的说法不正确的是(
)
A. 第一电离能:N>O>C
B. —NH2的电子式为
C. NH3的键角小于CH4
D. 基态N的核外电子轨道表示式为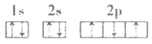
2. 下列性质的比较,不能用元素周期律解释的是(
)
A. 原子半径:S>Cl B. 还原性:H2Se>H2S
C. 结合质子能力:S2->Cl– D. 酸性:H2SO4>H3PO4
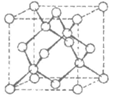
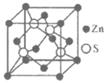
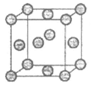
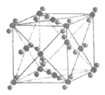
3. 下表是常见晶胞结构。下列说法不正确的是(
)
|
|
|
|
金刚石 | ZnS | Cu | 干冰 |
A. 金刚石是共价晶体,熔点关系为:金刚石>碳化硅>晶体硅
B. ZnS晶胞中含有4个Zn2+
C. Cu是金属晶体,配位数为6
D. 干冰是分子晶体,由于分子间作用力弱,所以干冰熔点低
4. 关于原子结构的下列说法中不正确的是(
)
A. 多电子原子中,2d能级的能量高于2p
B. C原子的基态电子排布式写成1s22s12p3,它违背了能量最低原理
C. 价电子中有3个单电子,该元素不一定属于主族元素
D. 电子云图中黑点密度越大,说明单位体积内电子出现的机会越大
5. 下列说法不正确的是(
)
A. 乙醇和甘油是同一类物质,但二者不是同系物
B. CH3CHO+HCN→CH3CH(OH)CN,该反应类型为加成反应
C. 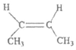 的名称为顺-2-丁烯
的名称为顺-2-丁烯
D. 某树脂 ,是由
,是由 和H2NCH2CH2NH2通过缩聚反应得到
和H2NCH2CH2NH2通过缩聚反应得到
6. NaCl是我们生活中必不可少的物质。将NaCl晶体放入水中,溶解过程如下图所示,下列说法正确的是(
)
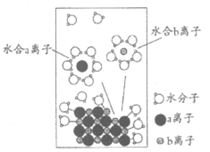
A. a离子为Na+
B. NaCl晶体中,Na+和Cl–的配位数均为4
C. 水合b离子的图示不科学
D. 室温下测定该NaCl溶液的pH小于7,是由于Cl–水解导致
7. 下列实验过程中,始终无明显现象的是(
)
A. NO2通入FeSO4溶液中 B. CO2通入CaCl2溶液中
C. CO2通入C6H5ONa溶液中 D. NH3通入AgCl浊液中
8. 常温下,下列各离子组在指定溶液中能大量存在的是(
)
A. pH=13的溶液中:Na+、ClO–、CO32-、SO42-
B. c(Fe3+)=0.1 mol/L的溶液中:H+、I–、Br–、SO42-
C. 使石蕊变红的溶液中:Na+、NH4+、NO3—、SO32-
D. 小苏打溶液中:Ba2+、Cl–、K+、OH–
9. NA代表阿伏伽德罗常数,下列说法正确的是(
)
A. 标况下22.4 LCl2与足量Fe反应生成FeCl3,转移电子数为3NA
B. KClO3+6HCl=3Cl2↑+KCl+3H2O,若产生71 gCl2,则转移电子数为2NA
C. N2(g)+3H2(g) 2NH3(g)
2NH3(g)
△H=-93kJ/mol,若该条件下1 molN2和6molH2反应,放热31kJ,则转移电子数为2NA
D. 1 molSiO2晶体中含有共价键数目为2NA
10. 关于有机物M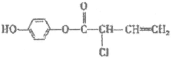 ,下列说法正确的是(
,下列说法正确的是(
)
A. M可以发生氧化、还原、加聚、缩聚反应
B. 可与浓溴水反应,1 mol M最多消耗2 mol Br2
C. 与NaOH溶液反应,1 mol M最多消耗3 mol NaOH
D. 可与H2反应,1 mol M最多与5 mol H2加成
11. 下列解释事实的方程式不正确的是(
)
A. 用FeCl3溶液制作铜质印刷线路板:2Fe3++Cu=Cu2++2Fe2+
B. Cu片置于NaNO3溶液中,无明显现象。再加入稀硫酸,Cu片溶解:
3Cu+8H++2NO3–=3Cu+2NO↑+4H2O
C. 向新制氢氧化铜悬浊液中滴加乙醛后加热,出现砖红色沉淀:
CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
D. Al片溶于NaOH溶液中产生气体:2Al+2OH–=2AlO2–+H2↑
12. 氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨催化制硝酸的流程示意图。下列说法不正确的是(
)
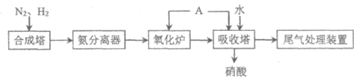
A. 可以利用NH3易液化的性质分离出NH3
B. 吸收塔中通入的A为氧气,是为了提高原料的利用率
C. 可以用NH3进行氮氧化物的尾气处理
D. 合成氨以及氨催化制硝酸的流程中氮元素均被氧化
13. 利用下列实验药品进行实验,能顺利达到实验目的的是(
)
实验目的 | 实验药品 | |
A | 除去粗盐中的Ca2+、Mg2+和SO42- | 粗盐、蒸馏水、NaOH溶液和Na2CO3溶液 |
B | 证明乙炔能和Br2反应 | 电石、饱和食盐水、CuSO4溶液和溴水 |
C | 检验溴乙烷中的溴原子 | 溴乙烷、NaOH溶液和AgNO3溶液 |
D | 验证乙醇消去产物有乙烯 | 乙醇、浓硫酸和溴水 |
14.
某同学通过实验研究铜盐溶液颜色的变化。下列说法不正确的是(
)
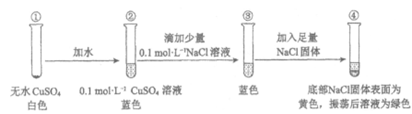
A. 由①②可知,②中溶液呈蓝色是Cu2++4H2O=[Cu(H2O)4]2+的结果
B. 由③④可知,发生了反应[Cu(H2O)4]2++4Cl– [CuCl4]2-+4H2O,[CuCl4]2-显黄色
[CuCl4]2-+4H2O,[CuCl4]2-显黄色
C. 由②③④可知,CuCl2溶液由稀到浓变化时,溶液颜色应由蓝到黄再到绿
D. 由本实验可知,溶液颜色丰富多彩,与形成配离子有关
Ⅱ卷
非选择题(共58分)
15.(12分)非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态F原子核外电子排布式为________________。
(2)O、F、Cl电负性由大到小的顺序为____________;OF2分子的空间构型为____________;OF2的熔、沸点__________(填“高于“或“低于“)Cl2O,原因是____________________________________________。
(3)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为______,下列对XeF2中心原子杂化方式推断合理的是______(填标号);
A. sp B. sp2 C. sp3 D. sp3d
已知XeF2的空间构型为直线型,则它是____________分子(填“极性“或“非极性“)。
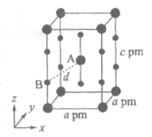
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有______个XeF2分子。已知XeF2的相对分子质量为M,阿伏伽德罗常数为NA,则晶胞密度为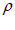 =________________g/cm3。
=________________g/cm3。
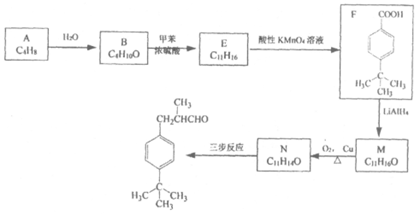
16.(8分)百合醛具有百合香味,常用作花香型化妆品的香料。其合成路线如下图所示(部分试剂和条件未注明):
已知:(R、R1、R2代表烃基)
i. 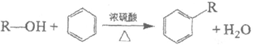
ii. 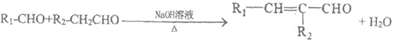
请回答:
(1)A所属的类别是_____________。
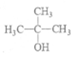
(2)B的结构简式为______________________。
(3)B→E、F→M的反应类型分别为___________________、_______________。
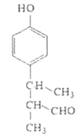
(4)写出符合下列条件的F的同分异构体的结构简式_______________。
a. 含有两个手性碳 b. 苯环上有两个对位取代基
c. 可发生银镜反应 d. 能与Fe3+显色
(5)以N和Q为有机原料经过三步反应可合成百合醛:
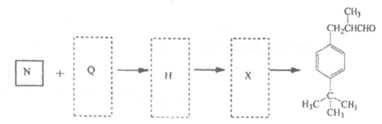
请写出Q、H、X的结构简式:Q_______、H_______、X_______。
17. (11分)(1)实验室里用下图装置制备SO2并验证其性质(图中夹持装置已略去):
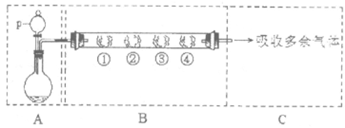
①装置A选用70%硫酸和亚硫酸钠固体制取SO2气体,化学方程式为:______________________________________。
②通过装置B完成表中设计实验,正确的是____________________。
选项 | A | B | C | D |
B中棉花位置 | ① | ② | ③ | ④ |
所蘸取试剂 | 紫色石蕊试液 | 品红溶液 | 淀粉和碘水 | 氢硫酸 |
现象 | 变红 | 褪色 | 溶液蓝色褪去 | 淡黄色固体 |
体现SO2性质 | 水溶液显酸性 | 漂白性 | 还原性 | 氧化性 |
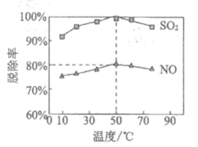
(2)工业为消除燃煤烟气中含有的SO2、NOx,研究者提出以NaClO溶液作为吸收剂进行一体化“脱硫“、“脱硝“。控制溶液的pH=5.5,将烟气中的SO2、NO转化为SO42-、NO3–。
①NaClO溶液吸收烟气中SO2的离子方程式是:____________________________。
②烟气中SO2和NO的体积比为4:1,脱除率见下图。则50℃时此吸收液中烟气转化生成的NO3–和Cl–的物质的量之比为________________。
③工业上利用氨水可以将SO2和NO2吸收,原理如下图所示:
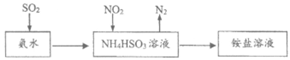
NO2被吸收的离子方程式是_______________________________。
(3)测定燃煤中硫元素含量,可用高温燃烧中和法,原理为:煤样在催化剂的作用下于氧气流中燃烧,煤中硫元素生成硫的氧化物(主要是SO2,还有少量SO3),吸收在H2O2溶液中,形成H2SO4,以标准的NaOH溶液滴定,根据NaOH溶液的消耗量计算煤中硫含量。若实验中称取煤样品mg,用足量H2O2溶液充分吸收后,得到V1 mL溶液。从中取出V2 mL,用c mol/L NaOH溶液平行滴定三次,消耗NaOH溶液体积的平均值为V3 mL。则该煤样品中硫的质量分数的计算表达式为____________________。
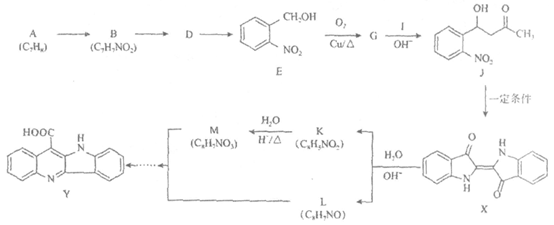
18. (12分)靛蓝类色素是人类所知最古老的色素之一,广泛用于食品、医药和印染工业。靛蓝(化合物X)和多环化合物Y的一种合成路线如下所示(部分反应条件或试剂略去)。
已知:
i. 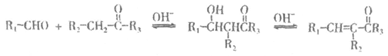
(1)A的名称是__________________。
(2)B→D和D→E均为取代反应,且D的相对分子质量比B大34.5。
写出D→E的方程式_______________________________________________。
(3)E→G的化学方程式是_______________________________________。
(4)I的结构简式是___________________________。
(5)J在一定条件下发生反应,可以生成化合物X、乙酸和水,生成物中化合物X和乙酸的物质的量比是_______________。
(6)K中除苯环外,还含有一个五元环,K的结构简式是___________________。
(7)已知:
ii. 
ⅲ. 亚胺结构(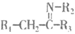 )中C=N键性质类似于羰基,在一定条件下能发生类似i的反应。
)中C=N键性质类似于羰基,在一定条件下能发生类似i的反应。
M与L在一定条件下转化为Y的一种路线如下图。
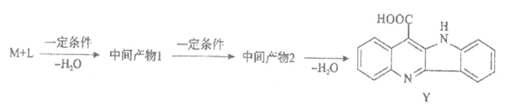
写出中间产物1、中间产物2的结构简式__________、__________。
(8)B有三种同分异构体,均为二元取代苯,且均为两性化合物,可通过蒸馏的方法来分离这三种混合物,它们中最先被蒸出来的是____________(写出结构简式)。
19. (15分)实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
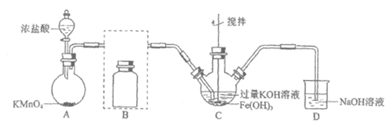
①A为氯气发生装置。A中反应方程式是___________________________(锰被还原为Mn2+);
氧化剂和还原剂的物质的量之比为______________。
②将除杂装置B补充完整并标明所用试剂。
③C中得到紫色固体和溶液。C中Cl2发生的反应有____________、_____________。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl–而产生Cl2,设计以下方案:
方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
I. 由方案I中溶液变红可知a中含有_________离子,但该离子的产生不能判断一定是K2FeO4将Cl–氧化,还可能由__________________产生(用方程式表示)。
II. 方案II可证明K2FeO4氧化了Cl–。用KOH溶液洗涤的目的是_____________________。
②根据K2FeO4的制备实验得出:氧化性Cl2______FeO42-(填“>“或“<“),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是__________________________________。
③资料表明,酸性溶液中的氧化性FeO42->MnO4–,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性FeO42->MnO4–。若能,请说明理由;若不能,进一步设计实验方案。
理由或方案:_______________________________________________________________。
参考答案
1-14:DCCAD CBACA DDBC
15. (12分)
(1)1s22s22p5
(2)F>O>Cl 角(V)形
低于
OF2和Cl2O都是分子晶体,结构相似,Cl2O的相对分子质量大,范德华力(或分子间作用力)大,所以Cl2O的熔、沸点高(2分)
(3)5 D 非极性
(4)2 2M/(NAa2c 10-30)
(2分)
16. (8分)
(1)烯烃
(2)
(3)取代反应、还原反应
(4)
(5)CH3CH2CHO 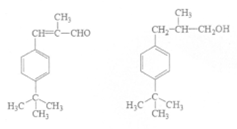
17. (11分)
(1)①Na2SO3+H2SO4=Na2SO4+H2O+SO2↑(1分)
②ABCD(2分)
(2)①SO2+ClO–+H2O=SO42-+Cl–+2H+(2分)
②2:13 (2分)
③4HSO3–+2NO2=4SO42-+N2+4H+(2分)
(3)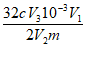
(2分)
18. (12分)
(1)甲苯(1分)
(2)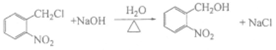
(3)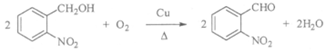
(4)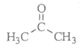 (1分)
(1分)
(5)1:2
(6)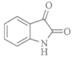
(1分)
(7)中间产物1: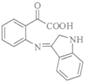 中间产物2:
中间产物2: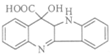 (各1分)
(各1分)
(8)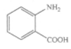 (1分)
(1分)
19. (15分)
(1)①2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O 1:5(1分)
② (1分)
(1分)
③3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KC1+8H2O Cl2+2OH–=Cl–+ClO–+H2O
(2)①i. Fe3+(1分) 4FeO42-+2OH+=4Fe3++3O2↑+10 H2O
ii. 排除ClO–的干扰(1分)
②>(1分)
溶液的酸碱性不同(1分)
③理由:FeO42-在过量酸的作用下完全转化为Fe3+和O2,溶液浅紫色一定是MnO4–的颜色
方案:向紫色溶液b中滴加过量稀H2SO4,观察溶液紫色快速褪去还是显浅紫色(1分)