北京师大附中2020-2021学年下学期高一年级期末考试化学试卷
本试卷有2道大题。考试时长90分钟,满分100分。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mg-24 Al-27 S-32 Cl-35.5 Br-80
一、选择题(24道小题,每小题2分,共48分,每小题只有1个选项符合题意)
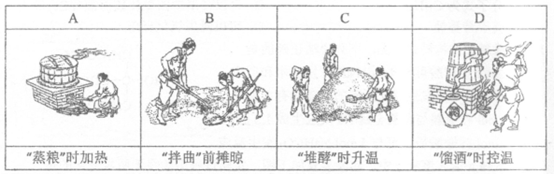
1.高粱酿酒过程中的部分流程按顺序排列如下,其中一定能说明高粱转化过程中放出热量的是
2.化学与生产、生活、科技息息相关,下列说法不正确的是
A.制玻璃和水泥都要用到石灰石
B.“神舟十一号“宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐
C.我国提出网络强国战略,光缆线路总长超三千万公里,光缆的主要成分是二氧化硅
D.华为首款5G手机搭载智能7nm制程SoC”麒麟980″手机芯片的主要成分是晶体硅
3.下面关于化学反应限度的叙述中,正确的是
A.化学反应的限度都相同
B.可以通过改变温度调控化学反应的限度
C.可以通过延长化学反应的时间改变化学反应的限度
D.当一个可逆反应在一定条件下达到限度时,反应即停止
4.下列有关物质表示方法不正确的是
A.乙烷的结构式是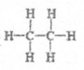 B.乙烯的球棍模型:
B.乙烯的球棍模型: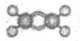
C.醋酸的分子式:C2H4O2 D.羟基的电子式:
5.下列化工生产原理正确的是
A.用电解法冶炼铝时,原料是氯化铝
B.可以将钠加入饱和氯化镁溶液中制取镁
C.可以电解熔融的氯化钠来制取金属钠
D.铝热反应需要高温的条件,所以铝热反应是吸热反应
6.下列关于烃的说法不正确的是
A.C3H8和C4H10一定是同系物
B.CH4的二氯代物只有一种结构
C.随分子中碳原子数的增加,烷烃的熔沸点升高
D.丙烷分子中,三个碳原子可能在同一条直线上
7.下列说法正确的是
A.糖类、油脂、蛋白质都是由C、H、O三种元素组成的
B.油脂有油和脂肪之分,都属于酯类
C.糖类、油脂、蛋白质都是高分子化合物
D.检验淀粉水解产物可在反应液中加入2mL 10%CuSO4溶液,再滴加5滴5%NaOH溶液,加热,若未观察到砖红色沉淀,说明淀粉还没有水解
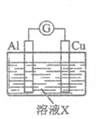
8.LED(LightEmittingDiode)即发光二极管,是一种能够将电能转化为光能的固态半导体器件。如图是某小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是
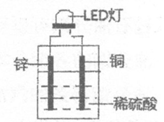
A.铜片上发生的反应为2H++2e-=H2↑
B.如果将稀硫酸换成柠檬汁,则导线中不会有电子流动
C.如果将锌片换成铁片,则电路中的电流方向保持不变
D.装置中存在“化学能→电能→光能“的转化
9.某温度下,在恒容的容器中进行反应:2SO2(g)+O2(g)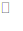 2SO3 (g),下列情况表示反应一定达化学平衡状态的是
2SO3 (g),下列情况表示反应一定达化学平衡状态的是
A.气体的密度不再随时间而改变 B.体系总质量不再随时间而改变
C.SO2(g)和SO3(g)的生成速率相同 D.SO2(g)和O2(g)的浓度比为2:1
10.下列实验方案得出的实验结论正确的是
选项 | 实验方案 | 实验结论 |
A | 将盐酸酸化的双氧水滴入Fe(NO3)2溶液中,溶液变黄色 | H2O2的氧化性比Fe3+强 |
B | 将一小块钠分别投入盛有水和乙醇的小 烧杯中,钠与乙醇反应要平缓得多 | 乙醇羟基中的氢原子不如水 分予中的氢原子活泼 |
C | 将某气体通入品红溶液,溶液褪色 | 气体中一定有SO2 |
D | 将铁棒和铜棒用导线连接后放入浓硝酸中,铜棒变细 | 铜的金属性强于铁 |
11.可以用来鉴别甲烷和乙烯,还可以用来除去甲烷中混有的少量乙烯的操作方法是
A.将混合气体通过盛有酸性高锰酸钾的洗气瓶
B.将混合气体通过盛有水的洗气瓶
C.将混合气体通过盛有足量溴水的洗气瓶
D.将混合气体通过盛有澄清石灰水的洗气瓶
12.化学与生产生活密切相关,下列说法不正确的是
A.用食盐、蔗糖等作食品防腐剂
B.用氧化钙作吸氧剂和干燥剂
C.用碳酸钙、碳酸镁和氢氧化铝等作抗酸药
D.用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以保鲜
13.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是
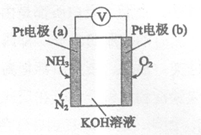
A.O2在电极b上发生还原反应
B.溶液中OH–向电极a移动
C.反应消耗的NH3与O2的物质的量之比为4:5
D.负极的电极反应式为:2NH3―6e-+6OH-=N2+6H2O
14.下列说法正确的是
A.煤的气化、液化和干馏都是物理变化
B.通过石油分馏可以获得大量的芳香烃
C.石油分馏的各馏分均是纯净物
D.石油分馏得到的汽油和石油催化裂化得到的汽油其成分不相同
15.在“绿色化学“工艺中,理想状态原子利用率为100%。以下反应最符合绿色化学原子经济性要求的是
A.氯乙烯发生加聚反应制得聚氯乙烯高分子材料
B.用乙酸与乙醇制备乙酸乙酯
C.用淀粉发酵反应制得食用酒精
D.用乙醇催化氧化制乙醛
16.下列关于药品和食品添加剂的说法正确的是
A.处方药的包装上印有“OTC”标识
B.阿司匹林化学名称为水杨酸,具有解热镇痛作用,可长期服用
C.果汁饮料中可以添加适量苯甲酸钠,它是一种抗氧化剂
D.小苏打是一种膨松剂,可用于制作面包
17.我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下:
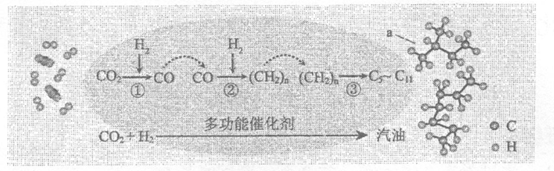
下列说法不正确的是
A.反应①的产物中含有水 B.反应②中只有碳碳键形成
C.汽油主要是C5~C11的烃类混合物 D.图中物质a有两种同分异构体
18.蜂胶中某活性物质X的结构简式如图,下列关于X的说法不正确的是

A.分子式为C17H16O4 B.可以使溴的四氯化碳溶液褪色
C.属于芳香烃 D.可以发生氧化反应
19.柠檬酸的结构简式如图,下列说法正确的是
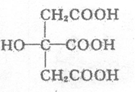
A.1 mol柠檬酸可与4 mol NaOH发生中和反应
B.柠檬酸中能发生酯化反应的官能团有2种
C.1 mol柠檬酸与足量金属Na反应生成1.5 mol H2
D.1 mol柠檬酸最多可与4 mol NaHCO3发生反应
20.将气体a通入溶液b中,实验装置如下图,实验过程中始终无明显变化的是
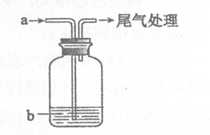
选项 | 气体a | 溶液b |
A | Cl2 | KI |
B | NO2 | FeSO4 |
C | SO2 | Ba(NO3)2 |
D | CO2 | CaCl2 |
21.某同学设计以下实验方案,从海带中提取I2。下列说法不正确的是
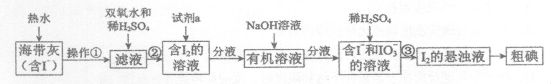
A.操作①是过滤
B.②中双氧水作还原剂
C.③的离子方程式是5I-+IO3-+6H+=3I2+3H2O
D.含I2的溶液经3步转化为I2的悬浊液,其目的是富集
22.碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
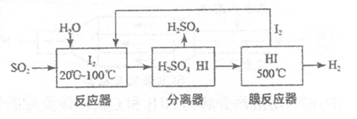
下列说法正确的是
A.分离器中的物质分离操作为过滤
B.该工艺中I2和HI的相互转化体现了“碘循环”
C.该工艺中HI的量没有改变,可视作该工艺的催化剂
D.碘循环工艺的总反应为2SO2+4H2O+I2=H2+2H2SO4+2HI
23.以TiO2为催化剂的光热化学循环分解CO2反应,为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
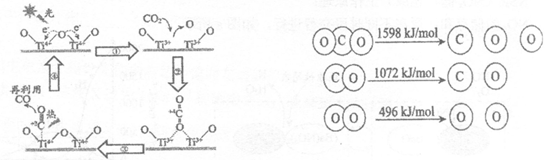
下列说法不正确的是
A.过程①中吸收能量使钛氧键发生了断裂
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以提高化学反应速率
D.2mol二氧化碳完全分解成2mol一氧化碳和1mol氧气需要吸热30kJ
24.某同学利用如图所示装置制备乙酸乙酯。实验如下:
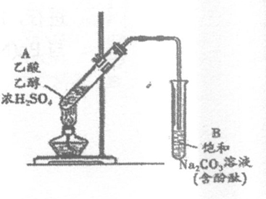
①向浓H2SO4乙醇混合液中滴入乙酸后,加热试管A
②一段时间后,试管B中红色溶液上方出现油状液体
③停止加热,振荡试管B,油状液体层变薄,下层红色溶液褪色
④取下层褪色后的溶液,滴入酚酞后又出现红色
结合上述实验,下列说法正确的是
A.①中加热有利于加快酯化反应速率,故温度越高越好
B.③中油状液体层变薄主要是乙酸乙酯溶于Na2CO3溶液所致
C.③中红色褪去的原因可能是酚酞溶于乙酸乙酯中
D.②中上层油状液体中只含有乙酸乙酯
二、非选择题(共6道小题,共52分)
1.高分子材料以其优越的特性成为21世纪的宠儿,被广泛应用于各个领域。
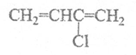
(1)已知氯丁橡胶主要成分的结构简式为: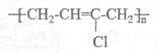 请写出合成它的单体的结构简式:___________________。
请写出合成它的单体的结构简式:___________________。
(2)聚乳酸(PLA)是一种新型的生物降解材料,具有广泛的应用,乳酸是合成聚乳酸的单体,其结构简式为: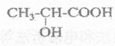 乳酸含有的官能团名称为____________、______________。
乳酸含有的官能团名称为____________、______________。
①乳酸在一定条件下可以生成CH2=CH-COOH,写出此物质在一定条件下发生加聚反应的化学方程式________________。
②乳酸在浓硫酸作用下,两分子相互反应生成六元环状结构的物质,产物的结构简式为_________________。
③请写出一种乳酸的同分异构体的结构简式 ____________(不含环状结构)。
2.A~I是常见有机物,它们之间的转化关系如下图所示。A是一种烃,其产量通常用来衡量一个国家的石油化工水平;E的分子式为C4H8O2;H为有香味的油状物质。
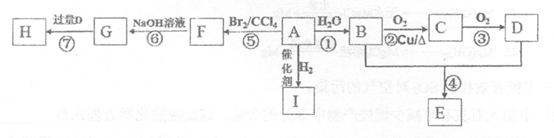
已知:CH3CH2Br+NaOH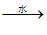 CH3CH2OH+NaBr
CH3CH2OH+NaBr
(1)F的结构简式为_____________________。
(2)①、②、⑥的反应类型分别为___________、______________、______________。
(3)有机物G可能具有的性质为__________________(填字母序号)。
a.与金属钠反应 b.与NaOH溶液反应 c.易溶于水
(4)请写出②和⑦的化学方程式
反应②________________________;反应⑦________________________。
(5)实验室用B和D反应制取E的装置如图所示。
①饱和Na2CO3溶液的作用为__________。
②实验结束,振荡试管乙,有无色气泡产生,其主要原因是__________________(用化学方程式表示)。
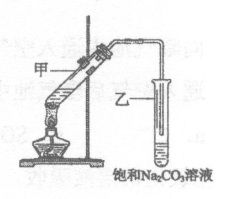
3.海洋中蕴含着丰富的资源。利用海水提取淡水、溴和镁的部分过程如下图所示。
(1)海水淡化的方法有_______________、离子交换法和电渗析法等。
(2)写出上图海水提溴中涉及反应的离子反应方程式:
①______________;②______________________。
能用空气吹出Br2而实现分离,是利用了溴单质的_____________。
(3)由Mg(OH)2得到单质Mg,以下方法最合适的是________________(填字母序号)。
A.Mg(OH)2 MgO
MgO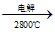 Mg
Mg
B.Mg(OH)2 MgO
MgO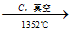 Mg
Mg
C.Mg(OH)2 无水MgCl2
无水MgCl2 Mg
Mg
D.Mg(OH)2 MgCl2溶液
MgCl2溶液 Mg
Mg
4.脱硫技术能有效控制SO2对空气的污染。
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是_____________________。
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、HCO3-等离子。含SO2的烟气可利用海水脱硫,其工艺流程如下图所示:
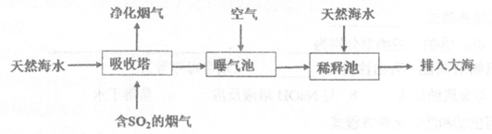
①向曝气池中通入空气的目的是____________________。
②通入空气后曝气池中海水与天然海水相比,浓度有明显不同的离子是____________
a.Cl- b.SO42- c.Br-
d.HCO3-
(3)用氢氧化钠溶液吸收,再通过电解的方式将硫元素转化为硫酸根,写出用足量的氢氧化钠溶液吸收二氧化硫的离子方程式______________;检验电解液中含有硫酸根离子的方法是:取少量电解液于试管中,_____________________________,可以证明。
5.SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
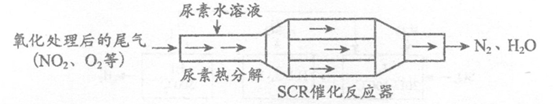
(1) SCR(选择性催化还原)工作原理:
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:______________________。
②反应器中NH3还原NO2的化学方程式:___________________。
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂
中毒。用化学方程式表示(NH4)2SO4的形成:_______________________。
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol-1)含量的方法如下:取ag尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL C1mol·L-1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是_________________。
(2) NSR (NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。
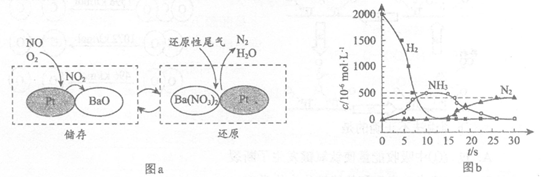
①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是__________________。
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是______________。
6.硝酸是氧化性酸,其本质是NO3-有氧化性,某课外实验小组进行了下列有关NO3-氧化性的探究(实验均在通风橱中完成)。
实验装置 | 编号 | 溶液X | 实验现象 |
| 实验I | 6mol·L-1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色。 |
实验Ⅱ | 15mol·L-1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色。 |
(1)写出铜与稀硝酸反应的离子方程式________________。
(2)实验I中,铝片作________________(填“正“或“负“)极。液面上方产生红棕色气体的化学方程式______________________。
(3)实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是_________________。
(4)进行实验Ⅲ:溶液X改为1mol·L-1稀硝酸溶液,观察到电流计指针向右偏转。反应后的溶液中含NH4+。生成NH4+的电极反应式________________________。
【查阅资料】活泼金属与1mol·L-1稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3-被还原。
(5)进一步探究碱性条件下NO3-的氧化性,进行实验Ⅳ(如图):
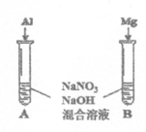
观察到A中有NH3生成,B中无明显现象。A、B产生不同现象的原因是_________________。
(6)将铝粉加入到NaNO3溶液中无明显现象,结合实验III和Ⅳ说明理由___________________________。
参考答案
一、选择题(每小题2分,共48分)
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
C | B | B | D | C | D | B | B | C | B | C | B |
13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 |
C | D | A | D | B | C | B | D | B | B | D | C |
二、非选择题(共52分)
1.(9分)
(1)
(2)羟基、羧基
①
②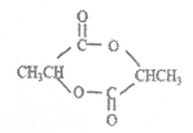
③CH2OHCH2COOH或CH3OCH2COOH (合理给分)
2.(13分)
(1) CH2BrCH2Br (2)加成,氧化,取代 (3) ac
(4) 2CH3CH2OH+O2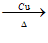 2CH3CHO+2H2O
2CH3CHO+2H2O
2CH3COOH+HOCH2CH2OH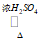 CH3COOCH2CH2OOCCH3+2H2O
CH3COOCH2CH2OOCCH3+2H2O
(5)①除去乙酸和乙醇、降低酯的溶解度、接收乙酸乙酯,利于分层
②2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O
3.(7分)
(1)蒸馏法
(2)①2Br-+Cl2=2Cl-+Br2
②Br2+SO2+2H2O==4H++SO42-+2Br-;挥发性 (3)C
4.(8分)
(1) 2CaCO3+2SO2+O2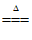 2CaSO4+2CO2
2CaSO4+2CO2
(2)①将+4硫转化为SO42-
②bd
(3) SO2+2OH-=SO32-+H2O
加入足量稀盐酸,再加入氯化钡溶液,产生白色沉淀
5.(8分)
(1)①CO(NH2)2+H2O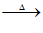 CO2+2NH3
CO2+2NH3
②8NH3+6NO2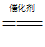 7N2+12H2O
7N2+12H2O
③2SO2+O2+4NH3+2H2O=2(NH4)2SO4
④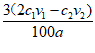
(2)①BaO ②8:1
6.(7分)
(1) 3Cu+2 NO3-+8H+=3Cu2++2NO↑+4H2O
(2) 负 2NO+O2=2NO2
(3)开始时Cu正极,Al为负极,后来Al在浓硝酸中发生钝化,因此Al为正极,Cu为负极,因此电流表指针向左边偏转
(4) NO3-+10H++8e-=NH4++3H2O
(5)铝与NaOH溶液反应产生氢气的过程中可将NO3-还原为NH3,而镁不与NaOH溶液反应
(6)铝在中性的硝酸钠溶液中没有氢气生成,NO3-不能被还原,因此无明显现象